Zukunftsperspektiven in der Pharmazeutischen Technologie
Zur zweiten Galenus Gastprofessur begrüßte Univ.-Prof. Dr. Andreas Bernkop - Schnürch, Leiter des Instituts für Pharmazeutische Technologie der Leopold- Franzens- Universität Innsbruck, den Schweizer Technologen Prof. Dr. Dr. h. c. mult. Hans Leuenberger, der bis 1982 für den Pharmakonzern Sandoz als Forschungsgruppenleiter tätig war und danach bis zu seiner Emeritierung 2006 das Institut für Pharmazeutische Technologie der Universität Basel leitete.
Nach Ende seiner Universitätslaufbahn gründete Leuenberger neben dem „Institute for the innovation in industrial pharmacy“ das „Center for innovation in computer-aided pharmaceutics, dessen Ziel es ist, neue, computergestützte, prozessorientierte Wege der Formulierung fester Arzneiformen zu entwickeln.
Diesem Thema war auch sein Vortrag unter dem Titel „Process Analytical Technology, Quality by Design and Innovations in the Pharmaceutical Industry“ gewidmet, den er zu Beginn seiner Gastprofessur im Rahmen einer Vortragsreihe des Centrums für Molekulare Biowissenschaften Innsbruck (CMBI) am 31. Mai dieses Jahres in englischer Sprache hielt.
Mit der Frage „Was haben eine Tablette und der Airbus 380 gemeinsam? Beide wollen sicher zur rechten Zeit an ihr Ziel kommen“, führte Leuenberger seine Zuhörer auf das Gebiet der Formulierung fester Arzneiformen, die nicht mehr im Labor „in vitro“, sondern am Computer „in silico“ konzipiert und überprüft werden, um Wirkstoffe kontrolliert und zielgenau freizusetzen. Was in der Flugzeugindustrie seit Jahren Standard ist, am Computer Flugzeuge zu konstruieren und zu überprüfen, dieses Computerdesign (CAD) wird es auch in Pharmazeutischen Technologie möglich machen, Innovationen bei festen Arzneiformen schneller der medizinischen Therapie zur Verfügung zu stellen. Gerade dieser Zeitvorsprung ist es, der in Zukunft immer wichtiger werden wird.
Der Studie „Pharma 2020“ von Price- waterhouse- Cooper, einer Schweizer Wirtschaftsprüfungs- und beratungsgesellschaft, zufolge, sollen bis zum Jahr 2020 die Forschungs- und Entwicklungsprozesse in der Pharmaindustrie durch die Einführung von CAD – Arzneimitteln um zwei Drittel schneller werden. PwC prognostizieren, dass klinische Studien um 40 % verkürzt werden und die Zahl der Probanden um mehr als 60 % zurückgehen kann.
Sind diese Vorgaben in der PwC-Studie überhaupt realistisch? Leuenberger bejahte diese Frage, denn in Zukunft könne ein großer Teil der Forschung und Entwicklung neuer Arzneimittel „in silico“ durchgeführt werden dank entsprechender Software und mittels Hochleistungscomputern. Dabei müsse die forschende Pharmaindustrie den Spagat schaffen, in der Entwicklung Zeit und Kosten zu sparen, und gleichzeitig die Qualität des Produkts zu steigern. Leuenberger erläuterte seine These an drei Beispielen. Die Entwicklung neuer Arzneimittel durch Computerdesign (CAD) folgt der so genannten 80/20 Regel, die besagt, dass 80 % der qualitätsrelevanten Ergebnisse in 20% der für das Projekt investierten Zeit erzielt werden können. Dieses Prinzip erlaubt es, Kosten für einzelne Projekte zu sparen, da es in der frühen Entwicklungsphase nicht sicher ist, ob dieses Projekt je den Markt erreichen wird. Leuenberger zeigte in seinem Vortrag, dass durch den Einsatz von Computerdesign (CAD) erhebliche Kosten gespart und gleichzeitig die Qualität wesentlich verbessert werden können. In diesem Zusammenhang wird das Ziel einer 100/10 Regel angestrebt, d.h. eine fehlerfreie, robuste Formulierung bei gleichzeitiger Halbierung der eingesetzten Ressourcen zu erzielen. Diese Vorgangsweise bedeutet gleichzeitig einen großen Zeitvorsprung für Innovationen. Ergänzend dazu ist die Entwicklung von Hilfsstoffen, die multifunktionell als Binde-, Füll- und Zerfallmittel eingesetzt werden, wie beispielsweise die mikrokristallinen Cellulose (MCC SANAQ burst), weit fortgeschritten. Im Rahmen der Entwicklung werden die CAD-konzipierten Arzneimittel dem Six-Sigma-Qualitätsmanagement unterworfen. Dadurch soll garantiert werden, dass Qualitätsunterschiede einzelner Tabletten (insbesondere im Freisetzungsprofil des Wirkstoffs) im Herstellungsprozess minimiert werden.
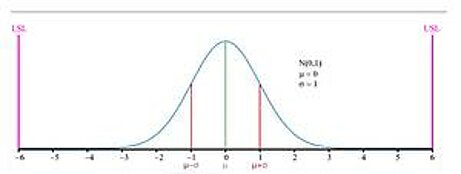
Schaubild der Normalverteilung, auf der die statistischen Grundannahmen des Six-Sigma-Modells beruhen. Der griechische Kleinbuchstabe σ (Sigma) steht für den horizontalen Abstand zwischen dem arithmetischen Mittelwert µ (Gipfelpunkt der Normalverteilungskurve) und dem Wendepunkt der Kurve. Je größer dieser Abstand ist, desto breiter sind die Werte des gemessenen Merkmals gestreut. In der hier gezeigten Abbildung sind die Spezifikationsgrenzen (USL, LSL) 6σ vom Mittelwert entfernt. Werte jenseits der Spezifikationsgrenzen sind extrem unwahrscheinlich, selbst wenn sich die Verteilungskurve später um 1,5σ nach links oder rechts verschieben sollte.
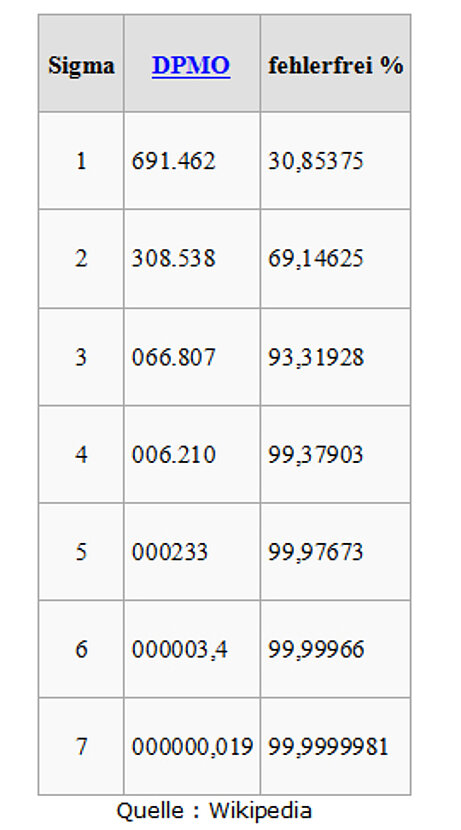
Der Name „Six Sigma“ kommt nun daher, dass bei Six Sigma die Forderung erhoben wird, dass die nächstgelegene Toleranzgrenze mindestens 6 Standardabweichungen (6σ, englisch ausgesprochen „Six Sigma“) vom Mittelwert entfernt liegen soll („Six-Sigma-Level“).[5] Nur wenn diese Forderung erfüllt ist, kann man davon ausgehen, dass praktisch eine „Nullfehlerproduktion“ erzielt wird, die Toleranzgrenzen also so gut wie nie überschritten werden. Bei der Berechnung des erwarteten Fehleranteils wird zusätzlich in Betracht gezogen, dass Prozesse in der Praxis, über längere Beobachtungszeiträume gesehen, unvermeidbaren Mittelwertschwankungen ausgesetzt sind. Es wäre also zu optimistisch, davon auszugehen, dass der Abstand zwischen dem Mittelwert und der kritischen Toleranzgrenze immer konstant 6 Standardabweichungen betragen würde. Basierend auf Praxisbeobachtungen hat es sich im Rahmen von Six Sigma eingebürgert, eine langfristige Mittelwertverschiebung um 1,5 Standardabweichungen einzukalkulieren. Wenn eine solche Mittelwertverschiebung tatsächlich eintreten sollte, wäre der Mittelwert also statt 6 nur noch 4,5 σ von der nächstgelegenen Toleranzgrenze entfernt.[5]Deswegen wird der Überschreitungsanteil für den „6-σ-Level“ mit 3,4 DPMO (Defects Per Million Opportunities, d. h. Fehlern pro Million Fehlermöglichkeiten) angegeben. Dies entspricht bei dem häufigsten Verteilungstyp, der Gaußschen Normalverteilung, der Wahrscheinlichkeit, dass ein Wert auftritt, der auf der Seite mit der nächstgelegenen Toleranzgrenze um mindestens 4,5 Standardabweichungen vom Mittelwert abweicht und somit die Toleranzgrenze überschreitet.[5] Die nachfolgende Tabelle[6][7] nennt DPMO-Werte für verschiedene Sigma-Level; alle diese Werte kalkulieren die erwähnte Mittelwertverschiebung um 1,5 σ ein. Der für 3 σ angegebene DPMO-Wert entspricht also zum Beispiel dem einseitigen Überschreitungsanteil für 1,5 σ, der für 4 σ entspricht dem einseitigen Überschreitungsanteil für 2,5 σ, usw.
Die Bezeichnung Sigma steht für die Standardabweichung des Merkmals, gibt also an, wie stark die Merkmalswerte einzelner Tabletten voneinander abweichen. Der Name Six Sigma verweist darauf, dass die maximale Abweichung des Merkmals nicht mehr als sechs Standardabweichungen (Six Sigma) betragen soll, um zu gewährleisten, dass die Qualitätsansprüche („Nullfehlerproduktion“) an das Produkt gewährleistet sind. Bei Herstellungsprozessen in der Praxis hat man jedoch die Beobachtung gemacht, dass Mittelwertschwankungen um 1,5 Sigma unvermeidlich sind, so dass auch Werte um 4,5 Sigma im Qualitätsmanagement akzeptiert werden, da auch in diesem Fall die Produktion noch zu ca. 99,6 % fehlerfrei ist.
In Zukunft werden Märkte, Aktionäre und staatliche Regulatoren immer stärker die Pharmaindustrie unter Druck setzen, preisgünstige und schnelle Innovationen in die Therapie einzuführen. Mit CAD- konzipierten Arzneimitteln kann die Pharmaindustrie auf diese Forderungen antworten. Sie bieten zudem den Vorteil, dass weniger klinische Versuche und Studien nötig sein werden. In Folge dessen können Forschungsprozesse beschleunigt und Innovationsraten verbessert werden, was dringend notwendig scheint, hält man sich vor Augen, dass aktuell nur 11% der in der vorklinischen Phase getesteten Arzneimittel auf den Markt kommen. Zudem soll bis zum Jahr 2020 die Entwicklungszeit eines neuen Medikaments von derzeit 8 auf eineinhalb Jahre sinken.
Prof. Leuenberger beendete seinen Vortrag mit einer konfuzianischen Weisheit. Der Mensch kann auf dreierlei Wegen klug handeln: Durch Nachdenken, das ist der edelste, durch Nachahmen, das ist der leichteste und durch Erfahrung, das ist der bitterste.
Welchen Weg die Pharmaindustrie gewählt hat, ist bereits entschieden.
______________________________________________________
Veröffenlichung von Prof. Leuenberger als PDF in Englisch hier